Výslovně řečeno, záhlaví otázky je jednou z nejčastěji kladených otázek - a neodmyslitelně nesprávných. Co se děje?
Trocha historie, teorie a zajímavostí
Prototypová olověná baterie byla vynalezena již v roce 1859 - a navrhované schéma se ukázalo jako velmi úspěšné (pro podrobnosti o jeho práci se obraťte na zájemce o učebnici chemie nebo Wikipedii). Jak název napovídá, olovo (a některé jeho sloučeniny) a roztok kyseliny jako plnicí elektrolyt se používají v této baterii - a kyselina je problém.
Zde použitá kyselina sírová (a nemůže být v tomto typu baterie nahrazena jinou) je velmi nepříjemná, extrémně žíravá sloučenina. Připomeňme si jednu školní zkušenost: vysoká koncentrace kyseliny sírové se nalije do sklenice granulovaného cukru - a po nějaké době černý „had“ vyleze z porézního uhlí (kyselina odebrala vodu ze směsi uhlohydrátů a přeměnila je na uhlí). Samozřejmě se v akumulátoru používá zředěná kyselina, která je neschopná - ale zde se nachází další nepříjemná vlastnost kyseliny sírové: za normálních podmínek je tato kyselina netěkavá! 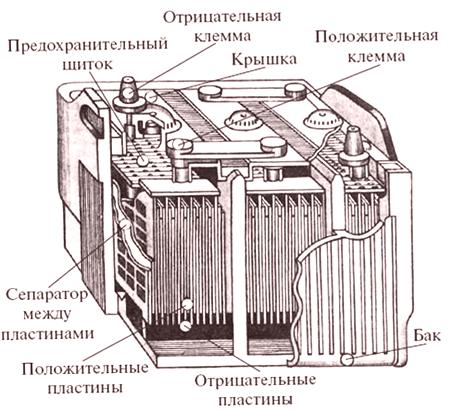
Z toho plyne, že kapka zředěné kyseliny se po chvíli z důvodu odpařování vody nechala „samo-koncentrovat“ - a voila, zde je nová díra na džínách nebo kniha zapomenutá vedle baterie! Odkud pocházejí mikrodropy kyselé hmoty?

Baterie
Všechno je jednoduché: na konciproces nabíjení (nebo při dobíjení) kyselý elektrolyt začíná „vařit“ (slovo není zbytečně uváděno v uvozovkách: proces nemá nic společného se skutečným varem - zde jsou na elektrodách emitovány plyny, které tvoří bubliny). Když taková bublina praskne, dostanou se nejmenší kapky kyseliny do vzduchu a jsou odváděny vnějším proudem vzduchu do značné vzdálenosti od baterie.
Nechť je gel!
Kromě „kyselého postřiku“ má obvyklá olověná baterie další nevýhody: změnu hladiny elektrolytu, kterou je třeba sledovat, problémy s únikem při prasknutí skříně a tak dále. Může se tomu vyhnout? Jasnou odpovědí je zahuštění elektrolytu přeměnou na gel. Nyní je jasné, že otázka je nesprávná v názvu: v obou případech se jedná o olověnou kyselinu (nebo jednoduše „kyselou“ baterii, protože název je v praxi zkrácen v praxi), ale v „gelovém“ elektrolytu používaném v tekutině jsou vlastnosti tekutiny „potlačovány“ buď jinak vytvořený gel.

Gel baterie
Jak se tedy liší?
Použití gelu umožňuje přeměnu baterie nabezúdržbovou(zapečetěnou) - což okamžitě odstraní nepříjemnosti popsané výše. Kromě toho taková baterie prakticky nepodléhá odlupování aktivní hmoty z desek, má nižší samovybíjení a díky tomu i vyšší životnost. Není však nic jiného, že „naše nedostatky jsou pokračovánímnaše zásluhy “- což je v tomto případě naprosto pravda. 
Gel mírně zvyšuje vnitřní odpor akumulátoru (snižuje maximální možný, špičkový proud - což ho činí velmi citlivým na zkrat) a přebíjení (přepětí při nabíjení) ho zpravidla ovlivňuje smrtelně. "Nemá rád" gelový elektrolyt a nízké teploty - zatímco celkový náboj a další indikátory mohou snadno klesnout dvakrát až čtyřikrát a vzhledem k "vrozené" těsnosti není taková baterie opravitelná (nebude uložena restaurování asymetrickými proudovými a podobnými „lidovými“ technikami, velmi často a docela úspěšně používanými v „reanimaci“ běžných kyselých baterií).
V každém případě mají motoristé na výběr - ale s domácím (domácím) použitím neexistuje prakticky žádná alternativa k gelové elektrolytové baterii: baterie pro zdroje nepřerušitelného napájení (UPS) jsou vyráběny pouze s touto technologií.







