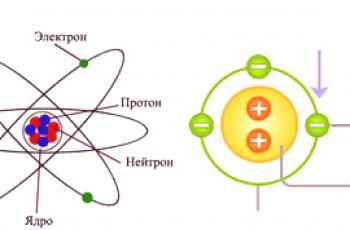
Atom
Atom lze považovat zaelementární částici homogenní látky . Taková látka se podle definice skládá pouze z jednoho chemického prvku (C, N, O a dalších z periodické tabulky). Je to nejmenší část takových prvků, které mohou být nositeli jejich vlastností, které se nazývají atom. Podle nejnovějších moderních pojmů se atom skládá ze tří složek: protonů, neutronů a elektronů.
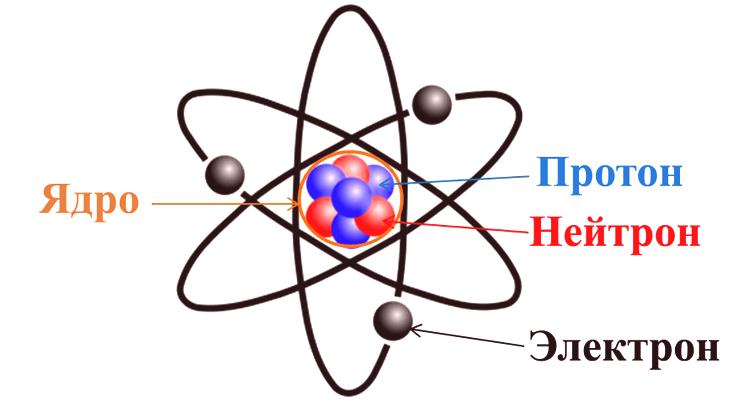
Atom
První dvě dílčí části společně tvořízákladní jádro , které má kladný náboj. Elektrony pohybující se kolem jádra zavádějí kompenzační náboj s opačným znaménkem. První závěr je tedy učiněn tak, že většina atomů je elektricky neutrální. Pokud jde o zbytek, atomy mohou díky různým fyzikálně-chemickým procesům buď připojit nebo uvolnit elektrony, což vede k náboji. Atom má hmotnost a velikost (určeno velikostí jádra) a určuje chemické vlastnosti látky.
Molekula
Molekula jeminimální strukturní jednotka látky . Taková látka může sestávat z několika chemických látekpoložek. Monoatomická substance jednoho chemického prvku, inertního argonu, může být také považována za molekulu. Stejně jako atomy je elektricky neutrální. Je možné ionizovat molekulu, ale je to mnohem obtížnější: atomy uvnitř molekuly jsou spojeny kovalentními nebo iontovými vazbami. Proto se stává mnohem obtížnější připojit nebo vyzvednout elektron. Většina molekul má komplexní architektonickou strukturu, kde každý atom zaujímá své místo předem.
Struktura molekuly vody
Atom a molekula: Obecné vlastnosti
Struktura . Obě částice jsou strukturálními jednotkami hmoty. V tomto případě atom znamená jeden konkrétní prvek, molekula již obsahuje několik chemicky vázaných atomů, ale struktura (pozitivní jádro s negativními elektrony) zůstává stejná.
Elektrická neutralita . V nepřítomnosti vnějších faktorů - interakce s jinou chemickou látkou, řízeným elektrickým polem a dalšími stimuly - atomy a molekuly nemají žádný náboj.
Náhrada . Atom může působit jako molekula v jednom případě - při práci s inertními plyny. Za molekulu lze považovat i monatomickou rtuť.
Přítomnost hmoty . Obě částice mají svou vlastní čistou hmotnost. V případě atomu, hmotnost závisí na chemickém prvku a je určena hmotností jádra (proton je téměř 1500 krát těžší než elektron, proto hmotnost záporné částice je často nebere v úvahu). Hmotnost molekulyna základě jejího chemického vzorce - prvků, které jej tvoří.
Atom a molekula: vynikající vlastnosti
Nedělitelnost . Atom je nejmenší prvek, ze kterého nelze vybrat ještě menší částici. (Získání iontu ovlivňuje pouze náboj, ale ne hmotnost). Molekula může být rozdělena na menší molekuly nebo může být rozložena na atomy. Proces rozkladu lze snadno dosáhnout pomocí chemických katalyzátorů. Někdy stačí, když látku zahřejete.
Svobodná existence . Molekula může volně existovat v přírodě. Atom existuje ve volné formě pouze ve dvou případech:
- Jako monoatomová rtuť nebo inertní plyn.
- V podmínkách vesmíru - jako samostatné atomy mohou být jakékoliv chemické prvky.
V ostatních případech je atom vždy součástí molekuly.
Vznik poplatku . Interakci mezi jádrem a elektronem v atomu lze snadno překonat i nejmenším elektrickým polem. Je tedy snadné získat pozitivní nebo negativní ion z atomu. Přítomnost chemických vazeb mezi atomy uvnitř molekuly vyžaduje aplikaci mnohem většího elektrického pole nebo interakci s jinou chemicky aktivní látkou.