Obecné informace o atomech a iontech
Atom je nejmenší částice látky, která má všechny své vlastnosti. Poloměr atomu se měří v pikometrech (metrech). Atom je elektricky neutrální, to znamená, že struktura nesoucí náboj se skládá z jádra a elektronů, které se kolem něj otáčejí. Jádro atomu se skládá z protonů a neutronů, které se také nazývají subatomární částice. Proton nese kladný náboj, který se rovná velikosti náboje elektronu. Neutrony nemají žádný poplatek. Počet elektronů v atomu odpovídá počtu protonů v jádru, což činí atom jako celek elektricky neutrální.
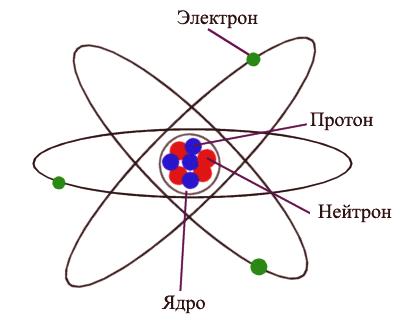
Atom
Ion je elementární částice nesoucí kladný nebo záporný náboj. Ion se vytváří v procesu oddělování nebo připojování elektronu k atomu nebo skupině atomů. Ion s negativním nábojem (atom s přebytkem elektronů) se nazývá anion a iont, který nese kladný náboj (atom s nedostatkem elektronů), se nazývá kation.
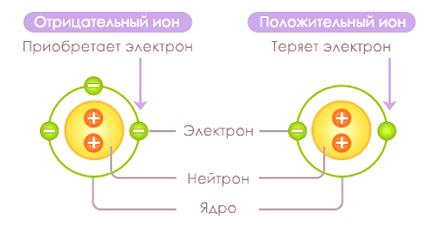
Ionty
Jak vzniká ionty
Ion se tvoří z atomu v procesu nazývanémionizace . Kation je tvořen, když elektron v atomu přijímá ionizační energii, což jí umožňuje překonat potenciální bariéru a pohybovat se od atomu, překonávající síly elektrostatické přitažlivosti. Vzdělávací procesAnion se vyskytuje s uvolněním energie, když atom dostane další elektron.
Ionizace může nastat v důsledku zvýšení teploty, vystavení elektrickému poli, rentgenovému záření nebo osvětlení.
Ionizace plynů
\ tNěkteré atomy netvoří záporné ionty. Například inertní plyny v důsledku zcela dokončené vnější elektronové hladiny nemohou připojit další elektron. Inertní plyny nereagují s jinými látkami za normálních podmínek. Ionizační energie inertních plynů je ve srovnání s atomy jiných chemických prvků velmi vysoká - od 10,8 eV pro radon do 24,6 eV pro helium. Taková velká hodnota ionizační energie komplikuje tvorbu iontů inertního plynu.
Všechny alkalické kovy (rubium, sodík, draslík, lithium, cesium, Francie) jsou dobrými redukčními činidly, tj. Snadno darují elektrony jiným atomům a mění se v kladně nabité ionty. K tomu dochází díky nízké ionizační energii - až 5 eV. Francius je nejmocnější restaurátor. Atomy tohoto elementu darují elektrony snadněji než jiné, díky velmi nízké ionizační energii. Alkalické kovy mají pouze jeden valenční elektron a je snazší je rozdělit než připojit sedm elektronů k dokončení energetické hladiny. Alkalické kovy se mohou proměnit v kladně nabité ionty jednoduše vystavením světlu.
Vodík má podobnou vlastnost. Jeho atom má jeden elektron a snadno ho odvádí, tvořící kation.
Halogeny - fluor, brom, jod, chlor a astatin (prvky, které jsou v hlavní podskupině 7. skupiny periodické tabulky) mají vysokou elektronegativitu - vlastnost posunu společných párů elektronů ve sloučenině. Oni snadno tvoří anionty, protože na vnější úrovni oni už mají 7 elektronů, a jediný chybí dokončit úroveň. Brom, chlor, jod a astatin mohou při kontaktu s více elektronegativními prvky vytvářet jak negativní, tak i pozitivní ionty. Fluor nikdy nevytváří pozitivní ionty, protože je prvkem s nejvyšší elektronegativitou a má vysokou ionizační energii.
Co je společné mezi atomem a iontem?
Atom a iont stejného prvku mají v jádru stejný počet protonů a neutronů.
Ion je označen stejným symbolem jako odpovídající chemický prvek v periodické tabulce, vpravo je uvedena pouze hodnota nabití.
Rozdíly mezi atomem a iontem
Hlavní rozdíl mezi atomem a iontem je ten, že ion je nabitá částice a atom není nabitý.
Rovněž atom a iont stejného prvku se liší hmotností v důsledku rozdílu v počtu elektronů. Kation má menší hmotnost než atom stejného prvku a anion je větší. Rozdíl mezi hmotností atomu a hmotností iontu je násobkem hmotnosti elektronu.
Iony, na rozdíl od atomů, nemají vlastnosti jednoduché látky. Příkladem jsou jodové krystaly, které jsou v plynném stavu tmavě modré.fialové a jeho ionty jsou bezbarvé. Jodové ionty nedávají barevnou reakci se škrobem a nejsou na rozdíl od krystalů jedovaté.
Podobným příkladem jeměď . Tento kov má zlatavě červenou barvu a jeho ionty jsou zeleno-modré.
Draslíkje stříbřitý kov, jehož atomy aktivně reagují s vodou, zatímco ionty této látky tuto vlastnost nemají. Stejný rozdíl je charakteristický pro vlastnosti atomů a iontů sodíku.
Kation vodíku v reakci s amoniakem tvoří amonný iont. Pro molekulu vodíku není tato reakce typická.
Na rozdíl od iontů nejsou atomy v přírodě samy o sobě. Výjimkou jsou pouze inertní plyny, které reagují s jinými prvky pouze za extrémních podmínek. Pokud je iont tvořen několika atomy, pak se významně liší od atomu ve velikosti a struktuře. Na rozdíl od atomu nepatří iont k elementárním částicím.
Ionty mají úplnou vnější energetickou hladinu - na ní je 8 elektronů. Tyto vlastnosti nemají žádné jiné atomy než inertní plyny.