Valence a stupeň oxidace jsou pojmy často používané v anorganické chemii. V mnoha chemických sloučeninách se hodnota valence a stupeň oxidace prvku shodují, proto se žáci a studenti často zmatují. Tyto koncepty mají opravdu něco společného, ale rozdíly jsou významnější. Abychom pochopili rozdíl mezi těmito dvěma koncepty, stojí za to vědět o nich více.
Informace o stupni oxidace
\ tStupeň oxidace je pomocné množství, které je přiřazeno atomu chemického prvku nebo skupiny atomů, což ukazuje, jak jsou společné páry elektronů rozděleny mezi interagující prvky.
Je to pomocná hodnota, která nemá fyzický smysl jako takový. Její podstata je jednoduše vysvětlena pomocí příkladů:
Molekula jedlé soliNaClse skládá ze dvou atomů - atomu chloru a atomu sodíku. Vazba mezi těmito atomy je iontová. Sodík má 1 elektron na úrovni valence, což znamená, že má jeden společný elektronový pár s atomem chloru. Z těchto dvou prvků je chlor více elektronegativní (má schopnost směšování elektronových párů k sobě), pak se k němu přesune pouze jeden společný pár elektronů. Ve sloučenině má prvek s vyšší elektronegativitou negativní oxidační stav, méně elektronegativní, resp. Pozitivní, a jeho hodnota se rovná počtu společných elektronových párů. U uvažované molekuly NaCl budou oxidační stavy sodíku a chloru vypadat takto:
+1 -1
NaCl
Chlor, selektronový pár přemístěný k tomu je nyní zvažován jako anion, to je atom, který má připojený další elektron k sobě, a sodík jako kation, to je atom, který daruje elektron. Při záznamu stupně oxidace na prvním místě je ale znaménko a ve druhé číselné hodnotě a při záznamu iontového náboje - naopak.
Stupeň oxidace může být definován jako počet elektronů, kterým pozitivní ion chybí na elektroneutrálním atomu, nebo který musí být odebrán z negativního iontu, aby oxidoval na atom. V tomto příkladu je zřejmé, že pozitivní ion sodíku v důsledku přemístění elektronového páru postrádá elektron a iont chloru má jeden další elektron.
Stupeň oxidace jednoduché (čisté) látky bez ohledu na její fyzikální a chemické vlastnosti je nulový. Například molekula O2sestává ze dvou atomů kyslíku. Mají stejné hodnoty elektronegativity, takže společné elektrony se k žádné z nich nepřevádějí. To znamená, že elektronový pár je striktně mezi atomy, protože stupeň oxidace bude nulový.
U některých molekul je obtížné určit, kde se elektrony pohybují, zejména pokud jsou v nich tři nebo více prvků. Pro výpočet stupně oxidace v takových molekulách je třeba použít několik jednoduchých pravidel:
- Atom vodíku má téměř vždy konstantní oxidační stav +1 ..
- U kyslíku je tento ukazatel -2. Jedinými výjimkami z tohoto pravidla jsou oxidy fluoridů .
+2 -1 +1 -1
OF2a O2F 2 ,
Vzhledem k tomu, že fluor je prvkem s nejvyšší elektronegativitou, vždy přesouvá interagující elektrony směrem k sobě. Podle mezinárodních pravidel se nejprve zaznamenává prvek s nižší elektricky zápornou hodnotou, protože kyslík je v těchto oxidech na prvním místě.- Pokud shrneme všechny oxidační stavy v molekule, dostaneme nulu.
- Pozitivní oxidační stav je charakteristický pro atomy kovů.
Při výpočtu oxidačních stavů je třeba mít na paměti, že největší oxidační stav prvku se rovná číslu jeho skupiny a minimální je číslo skupiny mínus 8. U chloru je maximální možný oxidační stav +7, protože je v 7. skupině a minimum je 7. -8 = -1. 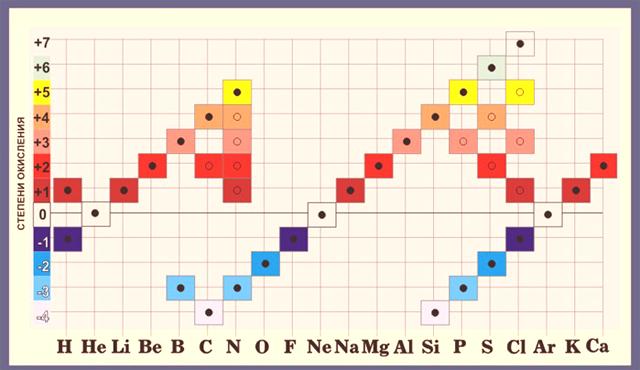
Obecné informace o valenci
\ tValence je počet kovalentních vazeb, které prvek může tvořit v různých sloučeninách.
Na rozdíl od stupně oxidace má pojem valence skutečný fyzikální význam.
Nejvyšší valence se rovná číslu skupiny v periodické tabulce. Síra S se nachází v 6. skupině, to znamená, že její maximální valence je 6. Ale může to být také 2 (H2S) nebo 4 (SO2 ).
Téměř všechny prvky jsou charakterizovány proměnlivou valencí. Existují však atomy, pro které je tato hodnota konstantní. Patří mezi ně alkalické kovy, stříbro, vodík (jejich valence je vždy 1), zinek (valence je vždy 2), lanthanum (valence je 3). 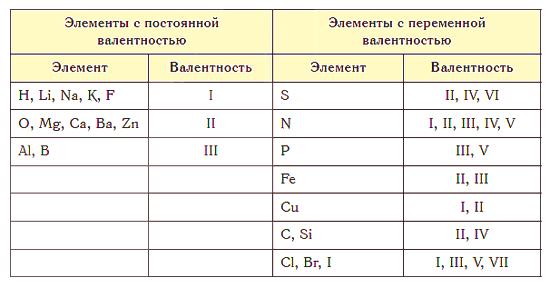
Co je společné valence a oxidaci
\ t- Odkazovat jak na, tak najiné hodnoty používají kladná celá čísla, která jsou psána nad latinským označením elementu.
- Nejvyšší valence, stejně jako největší stupeň oxidace, se shoduje s číslem skupiny prvku.
- Stupeň oxidace kteréhokoliv prvku v komplexní sloučenině se shoduje s číselnou hodnotou jednoho z valenčních ukazatelů. Například chlor, který je v 7. skupině, může mít valenci 1, 3, 4, 5, 6 nebo 7, což znamená, že možné oxidační stavy jsou ± 1, + 3, + 4, + 5, + 6, + 7.
Hlavní rozdíly mezi těmito pojmy
- Pojem "valence" má fyzikální význam a stupeň oxidace je pomocný termín, který nemá žádný skutečný fyzikální význam.
- Stupeň oxidace může být nula, vyšší než nebo menší než nula. Valence je přísně větší než nula.
- Valence zobrazuje počet kovalentních vazeb a stupeň oxidace - distribuce elektronů ve sloučenině.