V organické chemii existují dvě hlavní třídy etherů: jednoduché a komplexní. Jedná se o chemické sloučeniny vznikající při hydrolýze (štěpení molekuly vody). Ethery (které se také nazývají estery) se získají hydrolýzou odpovídajících alkoholů a estery (estery) se získají odpovídajícím alkoholem a kyselinou.
I přes podobný název jsou ethery a estery dvě zcela odlišné třídy sloučenin. Získávají se různými způsoby. Mají rozdílné chemické vlastnosti. Liší se strukturním vzorcem. Celkově existují jen některé z fyzikálních vlastností nejslavnějších svých zástupců.
Fyzikální vlastnosti esterů a esterů
\ tÉtery jsou špatně rozpustné ve vodě, nízkovroucí kapaliny, snadno hořlavé. Při pokojové teplotě jsou ethery příjemně vonící bezbarvé kapaliny. 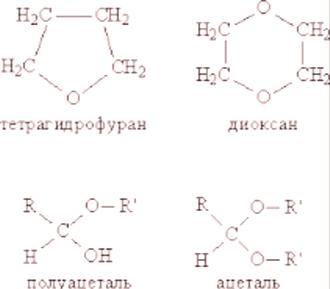
Nízkomolekulární estery - snadno se odpařují bezbarvé kapaliny, voní dobře, často ovoce nebo květiny. Se zvýšením uhlíkového řetězce acylové skupiny a zbytků alkoholu se jejich vlastnosti liší. Takové ethery jsou pevné látky. Jejich bod tání závisí na délce uhlíkových radikálů a struktuře molekuly.
Struktura etherů a esterů
\ tObě sloučeniny mají etherovou vazbu (-O-), ale v esterech je součástí složitější funkční skupiny (-COO), ve které je první atom kyslíku vázán na atom uhlíku jednoduchou vazbou (-O-). druhá dvojitá (= O).
Schematicky lze vyjádřit takto:
- Ether: R - O - R1
- Ester: R - COO - R1
V závislosti na radikálech v R a R1 se ethery dělí na:
- Symetrické estery - ty, ve kterých jsou alkylové radikály identické, například dipropylether, diethylether, dibutylether a podobně.
- Asymetrické nebo smíšené estery s různými radikály, například ethylpropyl ether, methylfenyl ether, butyl isopropyl atd.
Estery jsou rozděleny na:
- Estery alkoholu a minerálních kyselin: síran (-SO3H), dusičnany (-NO2) atd.
- Estery alkoholu a karboxylové kyseliny, například C2H5CO-, C5H9CO-, CH3CO- atd.
Zvažte chemické vlastnosti esterů. Étery mají nízkou reaktivitu, proto se často používají jako rozpouštědla. Reagují pouze v extrémních podmínkách nebo s vysoce reaktivními sloučeninami. Na rozdíl od esterů jsou estery reaktivnější. Snadno vstupují do reakcí hydrolýzy, zmýdelnění atd.
Étery
Reakce etherů s halogenovodíky:
Většina etherů se může rozložit, když je vystavena působení kyseliny bromovodíkové (HBr) za vzniku alkylbromidů nebo při interakci s kyselinou jodovodíkovou (HI) za vzniku alkyljodidů.
CH3 - O - CH3 + HI = CH3 - OH + CH3I
CH3 - OH + HI = CH3I + H2O
Tvorba oxoniových sloučenin:
Kyseliny sírové, jódové a jiné silné kyseliny při interakci s ethery tvoří sloučeniny oxonia - produkty sloučeninyvyššího řádu.
CH3 - O - CH3 + HCI = (CH3) 2O HCI
Interakce etherů s kovovým sodíkem:
Při zahřívání základními kovy, jako je kovový sodík, se ethery rozdělují na alkoholáty a alkylsodné.
СН3 - О - СН3 + 2Na = СН3 - ОNa + СН3 - Na
Autooxidace etherů:
V přítomnosti kyslíku se ethery pomalu autooxidují na hydroperoxid idalkylperoxid. Autooxidace je spontánní oxidace sloučeniny ve vzduchu.
C2H5-O-C2H5 + O2 = CH3-CH (UN) -O- C2H5
Estery
Hydrolýza esterů:
V kyselém prostředí ester hydrolyzuje za vzniku odpovídající kyseliny a alkoholu.
CH3 - COO - C2H5 = CH3 - COOH + H2O
Zmýdelnění esterů:
Při zvýšených teplotách reagují estery s vodnými roztoky silných zásad, jako je hydroxid sodný nebo draselný, za vzniku solí karboxylových kyselin. Soli kyselin uhličitých se nazývají mýdla. Vedlejším produktem saponifikační reakce je alkohol.
CH3 - COO - C2H5 + NaOH = CH3 - COONa + C2H5 - OH
Reesterifikační (výměnné) reakce:
Estery vstupují do výměnných reakcí působením alkoholu (alkoholýza), kyselin (acidolýza) nebo dvojité výměny za interakce dvou esterů.
СН3 - СОО - С2Н5 + С3Н7 - ОН = СН3 - СОО - С3Н7 + С2Н5 - ОH
CH3 - COO - C2H5 + C3H7 - COOH = C3H7 - COO - C2H5 + CH3 - COOH
СН3 - СОО - С2Н5 + С3Н7 - СОО - СН3 = СН3 - СОО - СН3 + С3Н7 - СОО - С2Н5
Reakce reagující s amoniakem:
Estersmůže reagovat s amoniakem (NH3) s tvorbou amidu a alkoholu. Stejným principem reagují s aminy.
СН3 - СОО - С2Н5 + NН3 = СН3 - СО - NHН + С2Н5 - ОH
Reakce na redukci esteru:
Estery mohou být redukovány vodíkem (H2) v přítomnosti chromitu mědi (Cu (Cr02) 2).
CH3 - COO - C2H5 + 2H2 = CH3 - CH2 - OH + C2H5 - OH